Gerade in Pharmaunternehmen ist die konkrete Planung und ökonomische Abschätzung des Markteintritts hochrelevant für die lange Entwicklungszeit und diverse Zeitpläne auf dem Weg. Das Münchner KI-Unternehmen Cellbyte nutzt die Daten der Zulassungsbehörden in Europa sowie des Erstattungswesens, um die Abschätzungen zu vereinfachen. Nun wurde eine Finanzierungsrunde geschlossen, die auch die Expansion in die USA ermöglichen soll.
ANZEIGE
Schlagwortarchiv für: EMA
Die Valneva SE sichert über eine Exklusivvereinbarung mit dem großen australischen Impfstoffvermarkter CSL Seqirus einen neuen Vertriebspartner für die deutsche Reisemedizin. Die Trennung vom bisherigen Partner Bavarian Nordic hatte wohl auch Gründe in einem wachsenden Interessenkonflikt.
Eine neue Landkarte der EMA über klinische Studien bietet einen reichen Datenschatz über die Indikationen und involvierten Zentren in den 27 EU-Mitgliedsländern. Die Daten werden wöchentlich aktualisiert und zeigen die hohe Aktivität der Regionen in diesem Bereich.
Ein Blick auf die Zulassungen von Wirkstoffen in Europa und den USA zeigt Ähnlichkeiten und deutliche Unterschiede für das vergangene Jahr. In Europa wurden erstmals mehr als doppelt so viele Medikamente zugelassen wie in den USA (ganz korrekt sollte man sagen: zur Zulassung empfohlen).
Die deutsch-französische TRICares GmbH hat nach einer 51 Mio. Euro-Serie C- nun eine 46 Mio. Euro-Serie D-Finanzierung eingefahren. Mit dem Geld will das in München und Paris ansässige Unternehmen zulassungsvorbereitende Machbarkeitsstudien für sein minimal-invasiv eingesetztes transfemorales Trikuspidalklappenersatzsystem Topaz in der EU und den USA finanzieren.
Die in München ansässige FGK Clinical Research GmbH erwirbt die britische Clinicology Ltd. und erweitert damit ihre territoriale Präsenz in Europa über den EMA-Zulassungsraum hinaus
Als Bedrohung für die EU-Arzneimittelforschung haben Verbände und Auftragsforschungsunternehmen das EU-Portal CTIS für klinische Studien bezeichnet.
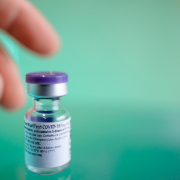
Während die FDA gestern angepasste Impfstoffe von BioNTech/Pfizer sowie Moderna schon gegen die aktuellen Virusvarianten von Sars-CoV-2, nämlich BA.4 und BA.5, per Notfallzulassung durchgewunken hat, gibt die europäische EMA nun einem angepassten Impfstoff von BioNTtech/Pfizer grünes Licht, der gegen eine Kombination aus Wildtyp (Wuhan) und Variante BA.1 wirken soll. Beide spielen im derzeitigen Infektionsgeschehen in Europa aber keine große Rolle mehr. Auch der Moderna-BA.1-Impfstoff wird zugelassen.
Statt einer Zulassungsmeldung kommt vom französisch-österreichischen Impfstoffentwickler Valneva SE eine Rückzugsmeldung nach der anderen. Nun wurde von dem Unternehmen in einem Vergleich mit Großbritannien die Kündigung der ursprünglichen Bestellung des "Tot-Impfstoffes" akzeptiert.
Für Valneva gibt es einen nächsten Rückschlag rings um den COVID-19-Impfstoff, der entweder "inaktivierter Virusimpfstoff" oder "Tot-Impfstoff" genannt wird. Die Europäische Kommission teilte dem Unternehmen mit, dass sie "beabsichtigt, den Vorabkaufvertrag für Valnevas inaktivierten COVID-19-Ganzvirus-Impfstoffkandidaten VLA2001 zu kündigen", wie das französisch-österreichische Unternehmen bekanntgab.

 Elnur Amikishiyev-stock.adobe.com
Elnur Amikishiyev-stock.adobe.com Valneva SE, Emma Pellet
Valneva SE, Emma Pellet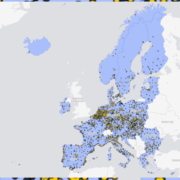 EMA/CETIS
EMA/CETIS Daniel Fuhr - stock.adobe.com
Daniel Fuhr - stock.adobe.com Bundesverband Medizinischer Auftragsinstitute (BVMA) e.V.
Bundesverband Medizinischer Auftragsinstitute (BVMA) e.V.
 Biontech SE
Biontech SE
